衡中同卷 2022-2023学年度上学期高三年级三调考试(新教材版L)化学试题答案
衡中同卷 2022-2023学年度上学期高三年级三调考试(新教材版L)化学试题答案,目前全国100所名校答案网已经汇总了衡中同卷 2022-2023学年度上学期高三年级三调考试(新教材版L)化学试题答案的各科答案和试卷,更多全国100所名校答案请关注本网站。

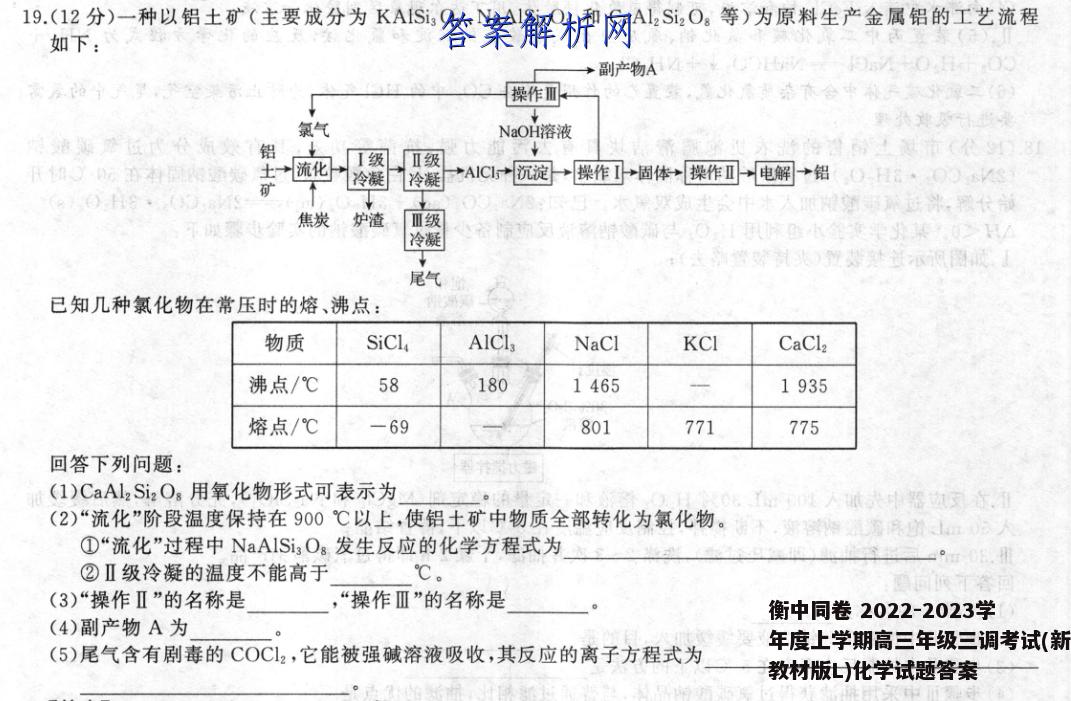


19.(12分)一种以铝土矿(主要成分为KAISi3Og、NaAlSi3O8和CaAl2Si2Og等)为原料生产金属铝的工艺流程如下:→副产物A⊙sA+00操作Ⅲ氯气NaOH溶液酒摩位代价须数铝任RO0示在村固阳经知→流化I级Ⅱ级冷凝冷凝*A1C1沉淀→操作I固体→操作口电解→铝OHC·OSAO18·083矿世阳领洗,激农领平理蔡州焦炭炉渣Ⅲ级冷凝发置礼火)型梦处武示风圆使尾气已知几种氯化物在常压时的熔、沸点:物质SiClAlClaNaClKCICaCl2沸点/℃5818014651935熔点/℃-69801771775回答下列问题:(1)CaAl2Si2Og用氧化物形式可表示为公了位00L人缺器边交亦.通(2)“流化”阶段温度保持在900℃以上,使铝土矿中物质全部转化为氯化物。谢下,的m0。①“流化”过程中NaAlSi3Og发生反应的化学方程式为4°过08②Ⅱ级冷凝的温度不能高于℃。圆可不答面(3)“操作Ⅱ”的名称是,“操作Ⅲ”的名称是(4)副产物A为要内娘为麻中患((5)尾气含有剧毒的COC12,它能被强碱溶液吸收,其反应的离子方程式为【答案】(1)CaO·Al2O3·2SiO2(2分)(2)①NaA1Si,O.+8C,+4C高温NaCl+A1Cl,+3SCL,+4CO,或NaA1Si,O。+8C,+8C高NaCl+AICl,十3SiCL,+8CO(2分)②180(2分)(3)煅烧(或灼烧)(1分)电解(1分)(4)H2(2分)(5)COCl2+4OH=C0?+2C1+2H2O(2分)【解析】铝土矿(主要成分为KAISi3Og、NaAlSis Os和CaAl2Si2Og等)和焦炭、氯气反应生成SiCL,、AlCl3NaCl、KCl、CaCl2、CO、CO2等,I级冷凝NaCl、KCl、CaCl2形成炉渣,而后经过Ⅱ级冷凝分离出AlCl3,SiCl,和COCl2经过Ⅲ级冷凝分离,AICl3加入适量的NaOH溶液形成Al(OH)3沉淀,过滤后的Al(OH)3经过煅烧生成氧化铝,电解熔融的氧化铝获得铝。(I)按金属性强弱从左到右写成氧化物的形式,且不能有分数,所以CaAl2Si2Og用氧化物形式可表示为CaO·Al2O3·2SiO2。(2)①“流化”过程中NaAlSi3Og与氯气和焦炭反应生成SiCl4、AlCl3、NaCl和碳的氧化物,所以发生反应的化学方程式为NaA1Si,0,+8C,十4C高温NaCl+A1C,+3SiCL,+4C0,或NaAISi,O,+8Cl,+8C高温NaCI十A1Cl3+3SiCl4+8CO。②Ⅱ级冷凝的目的是使A1CL3冷凝分离,所以温度不能高于180℃。(3)“操作Ⅱ”是Al(OH)3煅烧生成氧化铝,所以名称是煅烧,“操作Ⅲ”是电解NaCl溶液生成NaOH、Cl2和H2,所以名称是电解。(4)电解氯化钠溶液获得氯气、氢气和氢氧化钠,氯气和氢氧化钠循环利用,氢气为副产物,所以副产物A为H2。(5)COC2和强碱溶液反应可以生成对应价态的盐,所以离子方程式为COC2十4OHCO+2CI十2H2O。


16.(12分)探究钠及其化合物的性质,请按要求填空:(1)Na、Na2O、Na2O2、NaOH久置于空气中最终都变为(填化学式)。(2)将Na投人MgCl2溶液中出现的现象为(3)常温常压下制取100mL纯净的CO2,将其通入装有Na2O2粉末的硬质玻璃管中。①反应的化学方程式为②相同条件下,若反应后收集的气体体积为65mL,则反应消耗CO2的体积是mL.(4)现有一种以NaHCO3为主要成分的膨松剂,由于膨松剂存放时间较长,部分分解成Na2CO,粉末。为测定混合样品中NaHCO3的质量分数,按如图所示连接装置(装置的气密性良好,各装置中的试剂皆为足量)。K样品空气人收中处际西碱石灰AB浓硫酸碱石灰0E已知:碱石灰是固体氢氧化钠和氧化钙组成的混合物。实验过程:将m1g样品装入样品管中,测定实验前D的质量为m2g;打开K1、K2,关闭K,,缓缓鼓入空气数分钟,以除去装置中的二氧化碳;然后关闭K1、K2,打开K3,点燃酒精灯加热至不再产生气体;拆下装置,再次称量D的质量为m3g。①装置B中发生反应的化学方程式为②E处干燥管中盛放碱石灰的作用是如果没有该装置,可能会造成测定结果(填“偏高”“偏低”或“不变”)。③混合物中NaHCO3的质量分数为(用含m1、m2、m3的代数式表示)。【答案】(1)Na2CO3(1分)(2)有气体和白色沉淀产生(1分)【(3)①2Na2O2+2C02—2Na2C03+O2(1分)②70(2分)(4)①2NaHC0,△NaC0,+C0,↑+H,0(2分)9②防止空气中的CO2和水蒸气进入D中影响测定结果(2分)偏高(1分)③42m:-m2×100%(2分)4+11m1子中【解析】(1)空气中含有二氧化碳和水蒸气,在空气中的转化过程:Na→Na2O→NaOH→Na2CO3·10H2O→Na2 CO3,Na2O→NaOH→Na2CO3·10H2O→Na2CO3,Na2O2→NaOH+Na2C03·,10HzONa2CO3,NaOH→Na2CO3·l0H2O→Na2CO3,所以久置空气中最终都变为Na2CO3。(2)N与水反应生成氢氧化钠和氢气,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠。(3)①Na2O2与CO2反应生成碳酸钠和氧气,其反应的化学方程式为2Na2O2十2CO2一2Na2C03十O2。②根据反应:2C02+2Na2O2-2Na2C03+O2△V2VVx(100-65)mL解得x=70mL。(4)①装置B中为NaHCO,加热分解生成碳酸钠、二氧化碳和水,化学方程式为2 NaHCO,△Na,CO,十H2O+CO2↑。②干燥管中盛放的是碱石灰,碱石灰能吸收空气中的水蒸气和二氧化碳,所以干燥管的作用是防止空气中的CO2和水蒸气进入D中影响测定结果,如果没有这个装置将导致m?偏大,根据NaHCO3的质量分数计算式可知,导致结果偏高。③根据反应方程式可得4萨·置甲而麻置球面素答2NaHC0,△Na,C0,十H,0个+C02个家4,#长。家【2×8444(m3一m2)g造来长84×209M4442(m3-m2)42(m3-m2)建立关系式为,解得x=×100%。m3-m211,混合物中NaHCO3的质量分数为11m1



![[淄博一模]山东省淄博市2022-2023学年高三模拟考试数学试题答案](http://www.cqdaan.com/zb_users/cache/thumbs/e36701dc19f447d9390d1613ef082aa8-200-140-1.jpeg)

![[淄博一模]山东省淄博市2022-2023学年高三模拟考试语文试题答案](http://www.cqdaan.com/zb_users/cache/thumbs/3229bc3433491d58a1f6f84d27e656d9-200-140-1.jpeg)

![[淄博一模]山东省淄博市2022-2023学年高三模拟考试语文答案](http://www.cqdaan.com/zb_users/cache/thumbs/9f9fa2157e403bd98f9513ae28c38ce6-200-140-1.jpeg)
