衡中同卷 2022-2023学年度高考分科综合测试卷 全国卷A 政治(一)1答案
衡中同卷 2022-2023学年度高考分科综合测试卷 全国卷A 政治(一)1答案,目前全国100所名校答案网已经汇总了衡中同卷 2022-2023学年度高考分科综合测试卷 全国卷A 政治(一)1答案的各科答案和试卷,更多全国100所名校答案请关注本网站。

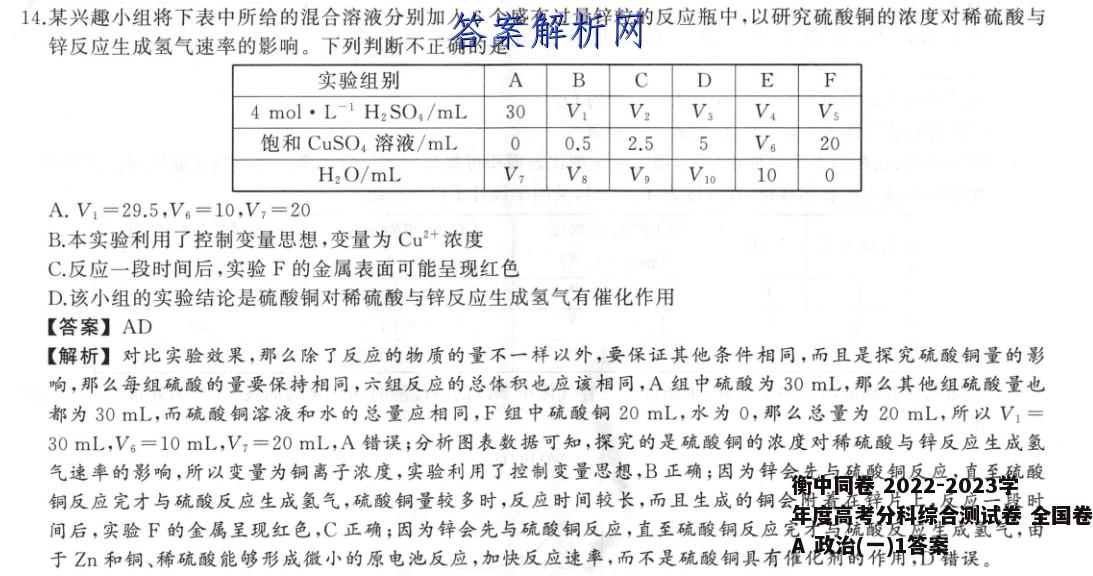
14.某兴趣小组将下表中所给的混合溶液分别加入6个盛有过量锌粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。下列判断不正确的是实验组别ABCE4mol·L-1H2S04/mL30VV2V3VVs饱和CuSO4溶液/mL00.52.55Va20H2O/mLVVsVoV10100A.V1=29.5,V6=10,V,=20B.本实验利用了控制变量思想,变量为Cu2+浓度C.反应一段时间后,实验F的金属表面可能呈现红色D.该小组的实验结论是硫酸铜对稀硫酸与锌反应生成氢气有催化作用【答案】AD【解析】对比实验效果,那么除了反应的物质的量不一样以外,要保证其他条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同,A组中硫酸为30L,那么其他组硫酸量也都为30mL,而硫酸铜溶液和水的总量应相同,F组中硫酸铜20mL,水为0,那么总量为20mL,所以V1=30mL,V6=10mL,V,=20mL,A错误;分析图表数据可知,探究的是硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响,所以变量为铜离子浓度,实验利用了控制变量思想,B正确;因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,反应一段时间后,实验F的金属呈现红色,C正确;因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,由于Z和铜、稀硫酸能够形成微小的原电池反应,加快反应速率,而不是硫酸铜具有催化剂的作用,D错误。
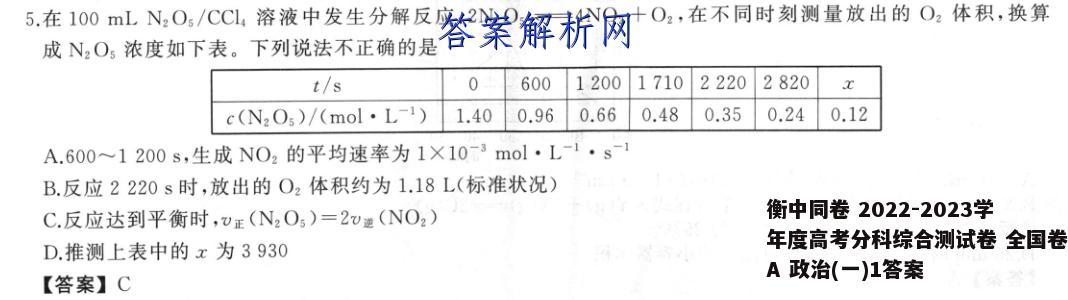

5.在100mLN2Os/CCL,溶液中发生分解反应:2N2O5一4NO2+O2,在不同时刻测量放出的O2体积,换算成N2O,浓度如下表。下列说法不正确的是t/s06001200171022202820c(N2O5)/(mol·L-1)1.400.960.660.480.350.240.12A.600~1200s,生成NO2的平均速率为1×103mol·LB.反应2220s时,放出的O2体积约为1.18L(标准状况)C.反应达到平衡时,v正(N2O5)=2v递(NO2)D.推测上表中的x为3930【答案】C【解析】600~1200s内平均速率v(N2O5)=(0.96-0.66)mol·L-1=5.0×10-4mol·L-1·s-1,反应为2N20600s一4NO2+O2,则600~1200s能生成NO2的平均速率v(NO2)=2u(N205)=2×5.0X10-4mol·L-1·s1=1.0×10-3mol·L-1·s1,A正确;0~2220s内N205的浓度变化为1.40mol·L1一0.35mol·L-11.05mol·L-1,△n(N205)=1.05mol·L-1×0.1L=0.105mol,反应为2N205=4N02+O2,则n(02)=2n(N0,)=0.105mol×号-=0.0525m0l,V(0,)=nV.=0.0525mol×2.4Lm0l≈1.18L,B正确:反应达到平衡时,2(N2O5)=v送(NO2),故C错误;由表中数据可知,剩余N2O5的浓度由0.96mol·L1→0.48mol·L→0.24mol·L1,所需时间均为1110s,所以剩余N205的浓度由0.24mol·L-1→0.12mol·L-1所需时间为1110s,即x=2820s十1110s=3930s,故D正确。



![[淄博一模]山东省淄博市2022-2023学年高三模拟考试数学试题答案](http://www.cqdaan.com/zb_users/cache/thumbs/e36701dc19f447d9390d1613ef082aa8-200-140-1.jpeg)

![[淄博一模]山东省淄博市2022-2023学年高三模拟考试语文试题答案](http://www.cqdaan.com/zb_users/cache/thumbs/3229bc3433491d58a1f6f84d27e656d9-200-140-1.jpeg)

![[淄博一模]山东省淄博市2022-2023学年高三模拟考试语文答案](http://www.cqdaan.com/zb_users/cache/thumbs/9f9fa2157e403bd98f9513ae28c38ce6-200-140-1.jpeg)
